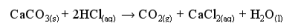鹽酸和碳酸鈣反應是不是酸鹼中和?
最近學生拿了一些理化問題來問我,其中一個問題提到鹽酸和碳酸鈣反應是不是酸鹼中和?學生認為不是,問他為什麼會何如此想?學生回答:因為碳酸鈣是鹽類,所以不是酸鹼中和。
其實鹽酸和碳酸鈣反應是中和反應,但是因為碳酸鈣在酸、鹼、鹽分類中是屬於鹽類,而課本中酸鹼中和的通式通常會如此寫:
酸 + 鹼 → 鹽 + 水
導致學生誤解為只有酸類與鹼類反應才是酸鹼中和反應,其實正確的說法應該是只要是酸性物質與鹼性物質反應即是酸鹼中和反應。
鹽類的酸鹼性依其組成之酸根、鹼根組合,可能為酸性、中性或鹼性。
中性:(例 氯化鈉 NaCl)
酸性:(例 硫酸銨 (NH4)2SO4)
鹼性:(例 碳酸鈉 Na2CO3)
碳酸鈣是屬於偏弱鹼性的鹽類,雖然碳酸鈣的溶解度非常的低,但是仍可使水中解離出微量的OH-離子導致水中[OH-]>[H+]。
所以鹽酸與碳酸鈣是酸性物質與鹼性物質反應,所以是酸鹼中和反應,其產物有水,也有鹽類。
![]() 歡迎引用,請注明來源出處!
歡迎引用,請注明來源出處!